I. Pendahuluan

[OH -] = K W / [H +]
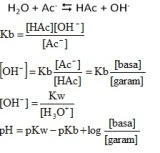
a. Campuran asam lemah dengan garam dari asam lemah tersebut.
Contoh:
CH3COOH dengan CH3COONa
H3PO4 dengan NaH2PO4
b. Campuran basa lemah dengan garam dari basa ldmah tersebut.
Contoh:· NH4OH dengan NH4Cl
Contoh
Soal:
Dalam struktur
molekul zat yang bervariasi mempengaruhi berat molekul zat tersebut, dimana
akan mempengaruhi sifat fisikokimia suatu zat, serta kemampuan obat dalam
mengabsorbsi.
Sistem
klasifikasi biofarmasetik diperkenalkan melalui sebuah metode untuk
mengidentifikasi situasi yang mungkin mengikuti uji disolusi in vitro yang
digunakan untuk memastikan bioekivalensi dalam ketidakhadiran studi
bioekivalensi klinik secara nyata. Pada dasarnya pendekatan secara teori
menyatak`n, kelarutan dan permeabilitas intestinal diidentifikasi sebagai
karakteristik pengobatan utama yang mengontrol absorpsi. Dalam klasifikasi
biofarmasetik tersebut telah membagi beberapa senyawa menjadi empat kelas
berdasarkan permeabilitas dan kelarutan. Sistem klasifikasi ini berguna dalam
memprediksi efek transporter penghabisan dan serapan pada penyerapan lisan
maupun di tingkat postabsorption sistemik setelah pemberian dosis oral dan
intravena.
Tabel
1. Klasifikasi Sistem Biofarmasetik
Kelas
|
Kelarutan
|
Permeabilitas
|
Korelasi Pada In Vivo
dan In Vitro
|
1
|
Tinggi
|
Baik
|
Korelasi pada in vivo dan in vitro jika laju
disolusi adalah rendah dari pada laju pengendapan pada lambung, jika tidak
maka hal tersebut terbatas/tidak ada korelasi.
|
2
|
Rendah
|
Baik
|
Korelasi pada in vivo dan in vitro diharapkan
apabila secara in vitro laju disolusi serupa dengan laju disolusi pada in
vivo, kecuali jika pada dosis yang sangat tinggi.
|
3
|
Tinggi
|
Buruk
|
Penyerapan (permeabilitas) merupakan laju yang
menetukan dan terbatas atau tidaknya korelasi pada in vivo dan in vitro
dengan laju disolusi.
|
4
|
Rendah
|
Buruk
|
Terbatas atau tidak adanya korelasi pada in vivo
dan in vitro yang diharapkan.
|
Pada kelas ini menunjukkan sejumlah daya serap yang
tinggi dan sejumlah disolusi yang tinggi. Tingkat ini membatasi mekanisme laju
pelepasan obat adalah pelarutan obat dan jika disolusi sangat pesat maka
tingkat penyerapan pada lambung menjadi tingkat penentuaan langkahnya.
·
Contoh:
Metoprolol,
Diltiazem, Verapamil, Propranolol.
·
Mereka
senyawa yang dapat diserap dengan baik dan tingkat penyerapan mereka biasanya ditandai
dengan adanya ekskresi yang lebih tinggi.
2.
Kelas
II - permeabilitas tinggi, kelarutan rendah
Pada kelas ini memiliki sejumlah daya
serap yang tinggi tetapi sejumlah disolusi yang rendah. Dalam disolusi obat in vivo maka
langkah rate limiting untuk penyerapannya, kecuali pada sejumlah dosis yang
sangat tinggi. Penyerapan untuk obat kelas II biasanya lebih lambat dan terjadi
selama periode yang lebih lama. Korelasi antara in vitro-In vivo biasanya
dikecualikan untuk kelas I dan kelas II obat-obatan.
·
Contoh:
Glibenklamid Fenitoin, Danazol,
Ketokonazol, asam mefenamat, Nifedinpine.
·
Para
bioavailabilitas produk tersebut dibatasi oleh
tingkat solvasi mereka. Sebuah korelasi antara in vivo bioavailabilitas dan in vitro solvasi dapat ditemukan.
3.
Kelas
III - permeabilitas rendah, kelarutan tinggi
Pada kelas ini permeabilitas adalah tingkat
membatasi langkah untuk penyerapan obat. Obat ini menunjukkan variasi yang
tinggi dalam tingkat absorpsi obat. Sejak terjadinya disolusi yang cepat, maka terjadi variasi berbeda yang
disebabkan adanya perubahan permeabilitas membran fisiologi dan bukan faktor
dosis formulir.
Pada kelas obat jenis ini memerlukan teknologi yang
mengatasi keterbatasan fundamental dari permeabilitas absolut atau daerah.
Peptida dan protein merupakan bagian dari kelas III dan teknologi penanganan
bahan-bahan tersebut mulai meningkat.
·
Contoh:
Simetidin,
Acyclovir, Neomycin B, Captopril.
·
Penyerapan
dibatasi oleh laju permeasi tetapi obat ini terlarut sangat cepat. Jika
formulasi tidak mengubah durasi waktu permeabilitas atau gastro-intestinal,
kemudian dapat menerapkan kriteria pada kelas I.
4.
Kelas
IV - permeabilitas rendah, kelarutan rendah
Pada kelas ini
menunjukkan banyak masalah untuk pemberian oral secara efektif. Untungnya,
contoh ekstrim dari senyawa kelas IV adalah pengecualian, bukan aturan dan
jarang dikembangkan dan mencapai pasar. Namun demikian sejumlah obat kelas IV
memang ada.
Pada obat kelas
ini menyajikan sebuah tantangan besar bagi pengembangan sistem pengiriman obat
dan rute pilihan untuk memberikan obat-obatan tersebut secara parenteral dengan
formulasi yang mengandung peningkat kelarutan.
·
Contoh:
Taxol,
hidroklorotiazid
·
Mereka
senyawa memiliki bioavailabilitas miskin. Biasanya senyawa ini tidak diserap
dengan baik selama mujosa pada usus dan diharapkan adanya variabilitas yang
tinggi.
Tabel 2. Model obat yang
disarankan untuk mengklasifikasikan permeabilitas senyawa obat yang baru.
Obat
|
Kelas Permeabilitas
|
Keterangan
|
Alpha-methyldopa
|
Rendah
|
Transporter Asam amino
|
Antipyrine
|
Tinggi
|
Penanda permeabilitas
|
Atenolol
|
Rendah
|
Paracellular, Standar internal
|
Caffeine
|
Tinggi
|
|
Carbamazepine
|
Tinggi
|
|
Hydrochlorothiazide
|
Rendah
|
Kelas IV
|
Furosemide
|
Rendah
|
Kelas IV
|
Ketoprofen
|
Tinggi
|
|
Mannitol
|
Tinggi
à
Rendah
|
Perbatasan penandaan
|
Metoprolol
|
Tinggi
|
Tinggi ke rendah penanda,
internal standar.
|
Naproxen
|
Tinggi
|
|
Polyethylene glycol
400±4000
|
Rendah
|
PEG 4000 dapat digunakan sebagai
penanda non-absorbable untuk pengkajian in vivo
|
Propanolol
|
Tinggi
|
|
Ranitidine
|
Rendah
|
Standar Internal
|
Theophylline
|
Tinggi
|
|
Verapamil
|
Tinggi
|
Opsi awal untuk karekterisasi
dari P-glycoprotein effluks dalam system in vitro
|
Dalam kinerja in
vivo obat tergantung pada kelarutan dan permeabilitas. Oleh karna itu, maka
dengan adanya sistem klasifikasi biofarmasi diharapkan dapat menjadi alat
pemandu untuk prediksi kinerja in vivo dari zat obat dan pengembangan sistem
pengiriman obat yang sesuai dengan kinerja yang diharapkan. Pengetahuan tentang
kelas biofarmasi dari bahan obat juga penting untuk suatu penelitian/riset
sehingga mengurangi biaya baik dari segi ekonomi dan waktu.
I.1
Larutan Dapar
Larutan
Dapar merupakan larutan yang memiliki sifat dapat mempertahankan atau relatif
tidak merubah nilai pH dengan adanya penambahan sedikit asam kuat atau basa
kuat dan adanya pengenceran. pH merupakan ukuran
konsentrasi ion hidrogen (H = +) (= proton) dalam
suatu larutan. Keasaman dalam larutan itu dinyatakan sebagai kadar ion hidrogen
yang disingkat dengan [H+], atau sebagai pH yang artinya –log [H+]. Dengan kata
lain pH merupakan ukuran kekuatan suatu asam.
pH suatu larutan dapat ditera dengan beberapa cara antara lain dengan
jalan menitrasi larutan dengan asam dengan indikator atau yang lebih teliti
lagi dengan pH meter. PH meter merupakan alat untuk mengukur tingkat keasaman
dan kebasa-an air. Pengukur PH tingkat asam dan basa air minum ini bekerja
secara digital, PH air dikatakan asam bila kurang dari 7, pH air dikatakan basa
(alkaline) bila lebih dari 7 dan pH air dikatakan netral bila pH=7. Yang
seringkali dirumuskan dalam persamaan berikut:
[OH -] = K W / [H +]
pOH = pKW − pH
Dimana a + H adalah aktivitas
dari ion hidrogen dalam satuan mol / L
(konsentrasi molar). Dengan demikian, unit pH adalah log
(L / mol), meskipun hal ini jarang diindikasikan secara eksplisit. Serta K
W berasal dari konstan air. Sehingga, pada suhu kamar pOH ≈ 14 − pH.
Namun hubungan ini tidaklah selalu berlaku pada keadaan khusus lainnya.
Larutan dapar
disebut juga larutan buffer atau larutan penyangga yang merupakan campuran asam
lemah dengan garamnya dari basa kuat atau campuran basa lemah dengan garamnya
dari asam kuat.
Tujuan
penggunaan larutan dapar tersebut dikarenakan adanya suatu system reaksi kimia yang
hanya berlangsung pada kondisi lingkungan yang mempunya pH tertentu. Misalnya
reaksi pemecahan protein di dalam lambung oleh enzim peptidase yang hanya dapat
berjalan dengan baik bila cairan lambung mempunyai pH=3-4. Oksigen dapat
terikat dengan baik oleh butir-butir darah merah bila pH darah sekitar 6,1- 7.
untuk menjaga agar pH larutan tersebut pada kisaran angka tertentu (tetap),
maka diperlukan suatu sitem yang dapat mempertahankan pH tersebut. Aksi dapar
merupakan hambatan atau tahanan dalam mempertahankan pH. Misalnya :
a. Campuran asam lemah dengan garam dari asam lemah tersebut.
Contoh:
CH3COOH dengan CH3COONa
H3PO4 dengan NaH2PO4
b. Campuran basa lemah dengan garam dari basa ldmah tersebut.
Contoh:· NH4OH dengan NH4Cl
Perlu
untuk diketahui, basa lemah jarang sekali dipakai sebagai larutan dapar
dikarenakan reaksinya yang seringkali tidak stabil yang dikarenakan oleh adanya
pengaruh desosiasi air. Terjadinya desosiasi air tersebut karna adanya pengaruh
perubahan suhu yang bervarian.
Koefisien Aktivitas dan Persamaan
Dapar
Koefisien aktivitas
merupakan faktor yang digunakan dalam termodinamika untuk menjelaskan penyimpangan dari perilaku ideal
dalam campuran dari zat kimia . Dalam sebuah campuran ideal , interaksi antara setiap pasangan senyawa kimia yang sama (atau lebih, dengan entalpi dari pencampuran adalah nol) dan, sebagai hasilnya,
sifat-sifat campuran dapat dinyatakan langsung dalam hal sederhana konsentrasi atau tekanan parsial zat tersebut misalnya pada hukum Raoult,
atau
dikenal dalam sifat anomaly air (keanehan air).
Penyimpangan dari idealistis ditampung dengan memodifikasi konsentrasi dengan koefisien aktivitas. Yang dh rumuskan sebagai
berikut:

Keterangan:
·
µ = kekuatan
ion
·
Ci =
konsentrasi ion
·
Zi = muatan
ion
|
1. Tentukan kekuatan ion dari:
a. BaSO4
b. Na2SO4
a. BaSO4
b. Na2SO4
1. a.
BaSO4 à Ba2+ + SO42-
0,1 M
µ= . (0,1 . 22) + (0,1 . 22)
µ= . (0,4 + 0,4)
µ= 0,4
b. Na2SO4 à 2Na+ + SO42-
0,1 M
µ= . (0,1 . 22) + (0,1 . 22)
µ= . (0,4 + 0,4)
µ= 0,4
b. Na2SO4 à 2Na+ + SO42-
0,1 M
µ=
. (0,2 . 12) + (0,1 . 22)
µ=
. (0,2 + 0,4)
µ= 0,3
Sifat larutan dapar adalah:
·
pH
larutan tidak berubah jika diencerkan.
·
pH
larutan tidak berubah jika ditambahkan ke dalamnya sedikit asam atau basa.
Fungsi
dari adanya larutan dapar dalam kehidupan sehari-hari dapat diklasifikasikan
sebagai berikut:
a. Pada Tubuh Manusia
Reaksi
kimia yang terjadi di dalam tubuh manusia merupakan reaksi enzimatis, yaitu
reaski yang melibatkan enzim sebagai katalis. Enzim sebagai katalis hanya dapat
bekerja dengan baik pada pH tertentu (pH optimumnya). Agar enzim tetap bekerja
secara optimum, diperlukan lingkungan reaksi dengan pH yang relative tetap,
unutk itu maka diperlukan larutan dapar.
Didalam
setiap cairan tubuh terdapat pasangan asam-basa konjugasi yang berfungsi
sebagai larutan dapar. Cairan tubuh, baik sebagai cairan intra sel (dalam sel)
dan cairan ekstra sel (luar sel) memerlukan system penyangga tersebut unutk
mempertahankan harga pH cairan tersebut. System penyangga ekstra sel yang
penting adalah penyangga karbonat ( H2CO3/HCO3-)
yang berperan dalam menjaga pH darah, dan system penyangga fosfat (H2PO4-/HPO42-)
yang berperan menjaga pH cairan intra sel.
b. Pada Industri
Dalam
indutri farmasi, larutan penyangga berperan untuk pembuatan obat-obatan agar
zat aktif dari obat tersebut mempunya pH tertentu. Selain itu larutan penyangga
juga digunakan unutk industri makanan dan minuman ringan seperti yang sering
digunakan adalah Natrium asetat dan asam sitrat.
Contohnya
pada asam sitrat, asam sitrat merupakan asam organik lemah yang ditemukan pada
daun dan buah tumbuhan genus Citrus (jeruk-jerukan). Senyawa ini merupakan
bahan pengawet yang baik dan alami, selain digunakan sebagai penambah rasa
masam pada makanan dan minuman ringan. Dalam biokimia, asam sitrat dikenal
sebagai senyawa antara dalam siklus asam sitrat, yang penting dalam metabolisme
makhluk hidup, sehingga ditemukan pada hampir semua makhluk hidup. Zat ini juga
dapat digunak`n sebagai zat pembersih yang ramah lingkungan dan sebagai
antioksidan.
Asam
sitrat terdapat pada berbagai jenis buah dan sayuran, namun ditemukan pada
konsentrasi tinggi, yang dapat mencapai 8% bobot kering, pada jeruk lemon dan
limau (misalnya jeruk nipis dan jeruk purut). Rumus kimia asam sitrat adalah
C6H8O7 struktur asam ini tercermin pada nama IUPAC-nya, asam 2-hidroksi-1,2,3-propanatrikarboksilat.
Keasaman asam sitrat didapatkan dari tiga gugus karboksil COOH yang dapat
melepas proton dalam larutan. Jika hal ini terjadi, ion yang dihasilkan adalah
ion sitrat. Sitrat sangat baik digunakan dalam larutan penyangga untuk
mengendalikan pH larutan. Ion sitrat dapat bereaksi dengan banyak ion logam
membentuk garam sitrat. Selain itu, sitrat dapat mengikat ion-ion logam dengan
pengkelatan, sehingga digunakan sebagai pengawet dan penghilang kesadahan air.
1.
Dapar Biologis In Vivo
A. Darah
Sebagai Sistem Dapar
Larutan dapar sangat penting dalam kehidupan; misalnya dalam
analisis kimia, biokimia, bakteriologi, zat warna, fotografi, dan industri
kulit. Dalam bidang biokimia, kultur jaringan dan bakteri mengalami proses yang
sangat sensitif terhadap perubahan pH. Karna kebanyakan reaksi-reaksi biokimia
dalam tubuh makhluk hidup hanya dapat berlangsung pada pH tertentu. Oleh karena
itu, cairan tubuh berperan sebagai larutan penyangga agar pH senantiasa konstan
ketika metabolisme berlangsung.
Darah dalam tubuh manusia mempunyai kisaran pH 7,35 sampai
7,45, dan apabila pH darah manusia di atas 7,8 yang disebut dengan alkalosis,
serta pH yang kurang dari 7,0 maka disebut dengan asidosis. Keadaan tersebut
merupakan efek pada tubuh yang menyebabkan organ tubuh manusia dapat rusak, oleh
karna itu kisaran pH harus tetap stabil dan di jaga dengan adanya larutan penyangga.
Buktinya, apabila dalam darah tidak memiliki buffer, maka ketika minum jus
jeruk yang kecut, tubuh kita dapat mengalami asidosis (pH darah asam). Derajat
keasaman merupakan suatu sifat keasaman kimia yang penting dari darah dan
cairan tubuh lainnya.
Walaupun sebagian besar ion H+ selalu ada sebagai hasil metabolisme
dari zat-zat, tetapi dalam keadaan yang setimbang harus selalu dipertahankan
dengan jalan membuang kelebihan asam tersebut. Hal ini disebabkan karena
penurunan pH sedikit saja menunjukk`n keadaan sakit atau efek serius pada organ
tubuh manusia. Untuk itu tubuh kita mempunyai hal-hal berikut:
1.
Sistem
buffer/dapar
Dimana berperan untuk mempertahankan
pH tubuh agar tetap normal, serta melindungi adanya perubahan
yang terjadi secara tiba-tiba dalam pH darah.
2.
Sistem
pernapasan.
Di sini dipakai buffer H2CO3/HCO3–
Misalnya konsentrasi H3O+
dalam darah naik, berarti pH-nya turun.
H3O+ + HCO3–
←⎯⎯⎯⎯→ H2CO3 + H2O
Bila pH turun maka pusat pernapasan
kita akan dirangsang, akibatnya kita bernapas lebih dalam sehingga kelebihan CO2
akan dikeluarkan melalui paru-paru. Sedangkan bila konsentrasi OH–
naik
H2CO3 + OH–
←⎯⎯⎯⎯→ HCO3– + H2O
Karena kemampuan mengeluarkan CO2
ini, maka bufer H2CO3 dan HCO3– paling baik
untuk tubuh.
3.
Ginjal
Ginjal kita juga menolong untuk
mengatur konsentrasi H3O+ dalam darah agar tetap konstan,
dengan jalan mengeluarkan kelebihan asam melalui urine, sehingga pH urine dapat
berada sekitar 4,8 – 7,0.
Kegunaan larutan dapar tidak hanya
terbatas pada tubuh makhluk hidup. Reaksi-reaksi kimia di laboratorium dan di
bidang industri juga banyak menggunakan larutan dapar. Reaksi kimia tertentu
ada yang harus berlangsung pada suasana asam atau suasana basa. Serta buah-buahan
dalam kaleng perlu dibubuhi asam sitrat dan natrium sitrat untuk menjaga pH
agar buah tidak mudah dirusak oleh bakteri.
Dalam system dapar dalam darah dibagi menjadi dua,yaitu
dapar primer (pada plasma) dan dapar skunder (pada eritrosit). Dapar primer
pada plasma dibagi menjadi dua system, yaitu Bikarbonat-Asam karbonat (Gifford)
dan Na dihidrogen fosfat-Asam fosfat (Soerensen). Sedangkan pada system dapar
skunder dibagi menjadi dua, yaitu Hemoglobin-Oxyhemoglobin dan Kalium
Dihidrogen fosfat-Asam fosfat. Jadi dalam dalam beberapa faktor penting yang
terlibat dalam pengendalian pH darah, diantaranya adalah penyangga karbonat,
penyangga hemoglnbin dan penyangga fosfat.
1.
Penyangga
Karbonat
Penyangga karbonat berasal dari campuran asam karbonat (H2CO3
) dengan basa konjugasi bikarbonat (HCO 3 ).
H2 CO3 (aq) à
HCO3(aq) + H+ (aq)
Orang yang mendaki gunung tanpa oksigen tambahan dapat
menderita alkalosis, yaitu keadaan dimana darah terlalu banyak
mengandung basa (sedikit mengandung asam) dan kadang menyebabkan meningkatnya
pH darah. Kadar oksigen yang sedikit di gunung dapat membuat para pendaki
bernafas lebih cepat, sehingga gas karbondioksida yang dilepas terlalu banyak,
padahal CO2 dapat larut dalam air menghasilkan H2CO3.
Hal ini mengakibatkan pH darah akan naik. Kondisi alkalosis dapat mengakibatkan
hiperventilasi (bernafas terlalu berlebihan, kadang-kadang karena cemas
dan histeris). Keadaan alkalosis dapat dibagi menjadi dua, yakni alkalosis
metabolic dan alkalosis respiratorik. Alkalosis Metabolik adalah suatu keadaan
dimana darah dalam keadaan basa karena tingginya kadar bikarbonat, sebab tubuh
kehilangan terlalu banyak asam. Sedangkan alkalosis respiratorik adalah suatu
keadaan dimana darah menjadi basa karena pernapasan yang cepat dan dalam
menyebabkan kadar karbondioksida dalam darah menjadi rendah.
2.
Penyangga
Hemoglobin
Pada darah, terdapat hemoglobin yang dapat mengikat oksigen
untuk selanjutnya dibawa ke seluruh sel tubuh. Reaksi kesetimbangan dari
larutan penyangga oksi hemoglobin adalah:
HHb + O 2 (g) <.span> ←⎯⎯⎯⎯→ HbO 2- + H +
Asam hemoglobin ion aksi hemoglobin
Keberadaan oksigen pada reaksi di atas dapat memengaruhi
konsentrasi ion H+, sehingga pH darah juga dipengaruhi olehnya. Pada
reaksi di atas O2 bersifat basa. Hemoglobin yang telah melepaskan O2<.sub>
dapat mengikat H+ dan membentuk asam hemoglobin. Sehingga ion H+
yang dilepaskan pada peruraian H2CO3 merupakan asam yang
diproduksi oleh CO2 yang terlarut dalam air saat metabolisme.
3.
Penyangga
Fosfat
Pada cairan intra sel, kehadiran penyangga fosfat sangat
penting dalam mengatur pH darah. Penyangga ini berasal dari campuran dihidrogen
fosfat (H2PO4-) dengan monohidrogen fosfat
(HPO32- ).
H2PO4- (aq) + H+
(aq) à H2 PO4(aq)
H2PO4- (aq) + OH-
(aq) àHPO4 2- (aq)
) + H2O (aq)
Penyangga
fosfat dapat mempertahankan pH darah pada pH 7,4. Penyangga di luar sel hanya
sedikit jumlahnya, tetapi sangat penting untuk larutan penyangga urin.
Berikut
ini rentang klasifikasi pH pada larutan beserta authornya:
Dapar dalam Farmasetik (Obat-Obatan)
Dalam bidang farmasi (obat-obatan) banyak zat aktif yang
harus berada dalam keadaan pH stabil. Perubahan pH akan menyebabkan khasiat zat
aktif tersebut berkurang atau hilang sama sekali. Untuk obat suntik atau obat
tetes mata, pH obat-obatan tersebut harus disesuaikan dengan pH cairan tubuh, cairan tubuh ini
bisa dalam cairan intrasel maupun cairan ekstrasel. Dimana sistem penyangga
utama dalam cairan intraselnya seperti H2PO4- dan HPO42-
yang dapat bereaksi dengan suatu asam dan basa. Begitu juga obat suntik harus disesuaikan dengan pH darah
(pH 7,4) agar tidak menimbulkan alkalosis atau asidosis pada darah. Sedangkan
pH untuk obat tetes mata harus disesuaikan dengan pH air mata agar tidak
menimbulkan iritasi yang mengakibatkan rasa perih pada mata.
Oleh karna itu, sediaan tetes mata sebaiknya dibuat mendekati isotonis agar
dapat diterima tanpa rasa nyeri dan tidak dapat menyebabkan keluarnya air mata,
yang dapat mencuci keluar bahan obat yang terkandung didalamnya. Dalam
pembuatan larutan yang mendekati isotonis, dapat digunakan medium isotonis atau
sedikit hipotonis, dimana pada umumnya digunakan natrium-klorida (0,7-0,9%)
atau asam borat (1,5-1,9%) steril.
Cairan mata
isotonik dengan darah dan nilai isotonisitasnya sama dengan larutan NaCl P 0,9%.
Tujuan penggunaan prinsip dapar pH dalam kinerja obat tetes mata ini adalah
untuk mencegah kenaikan pH yang disebabkan oleh pelepasan lambat ion hidroksil
dari wadah kaca. Kenaikan pH dapat mengganggu kelarutan dan stabilitas obat.
Pada garam alkaloid berperan paling efektif pada pH optimal untuk pembentukan
basa bebas tidak terdisosiasi. Tetapi pada pH ini obat mungkin menjadi tidak
stabil, sehingga pH harus diatur dan dipertahankan tetap dengan penambahan
dapar. Air mata mempunyai kapasitas
dapar yang baik. Obat mata akan merangsang pengeluaran air mata dan penetralan
akan terjadi dengan cepat asalkan kapasitas dapar larutan obat tersebut kecil
(jumlah mol asam dan basa konjugat dari pendapar kecil). Garam alkaloid
bersifat asam lemah dan kapasitas daparnya lemah. Satu atau dua tetes larutan
obat mata ini akan dinaikkan pHnya oleh air mata.
Faktor dalam pembuatan larutan dapar
farmasetis yaitu:
1.
Pilih
asam lemah yang memiliki pKa mendekati pH dapar
2.
Hitung
rasio garam dan asam lemah yang diperlukan (pers. Henderson-Hasselbach)
3.
Tentukan
konsentrasi individual g`ram dan asam yang diperlukan untuk memperoleh
kapasitas dapar yang mencukupi (pers. Van Slyke)
4.
Faktor
lain yang harus diperhatikan:
a. Ketersediaan bahan kimia
b. Sterilitas larutan akhir
c. Stabilitas bahan obat dan dapar
d. Harga bahan baku
e. Tidak toksik
5.
Cek
pH dengan alat yang “reliable”.
Penyesuaian Tonisitas dan pH
- Data Pelarut Cryoscopic dan Ebuillioscopic
Ada
empat metode penyesuaian isotonicity/ tonisitas dengan pH, yang seringkali digunakan
sebagai intra vena suntikan atau untuk digunakan pada mata atau saluran hidung
atat telinga. Dimana cairan yang masuk dalam tubuh harus menjadi isotonik
dengan cairan tubuh. Hal ini dapat dilakukan oleh salah satu dari empat metode
berikut ini:
1. Cryoscopic Metode:
Darah
memiliki titik beku -0,52oC. Jadi untuk solusi apapun untuk menjadi
isotonik dengan darah, itu juga harus memiliki depresi dari 0,52oC.
Untuk sejumlah obat depresi titik beku disebabkan oleh larutan 1% diberikan
dalam tabel di atas
Langkah-langkah:
Kami
mengetahui depresi titik beku disebabkan oleh jumlah yang diberikan obat dalam resep dalam volume tertentu air.
Kami kurangi dari 0,52.
2. Metode NaCl Ekivalen:
Setara natrium klorida juga dikenal sebagai "setara tonicic". Natrium klorida setara dengan obat adalah jumlah natrium klorida yang setara dengan (yaitu, memiliki efek osmotik sama dengan) 1 gram, atau berat lainnya unit, obat. Nilai-nilai natrium klorida setara obat banyak tercantum dalam tabel. Dalam metode ini kita mengetahui nilai T dari obat, baik dari tabel atau dari formula:
Untuk depresi yang tersisa di titik beku, kita tambahkan natrium klorida yang cukup, tahu bahwa sodium klorida 1% memiliki titik beku yang titik penurunan 0,58 C.
Dimana E adalah natrium klorida nilai setara M adalah Berat Molekul L iso merupakan faktor yang tergantung pada keadaan ionik garam.
·
Untuk
elektrolit Non L iso 1,9
·
Lemah
elektrolit L iso adalah 2,0
·
Divalen
elektrolit L iso adalah 2,0
·
Uniuni
valent elektrolit L iso adalah 3,4
·
Unidi
valent elektrolit L iso adalah 4,3
·
Diuni
valent elektrolit L iso 4.8
·
Unitrivalent
elektrolit L iso 5,2
·
Tri
univalen elektrolit L iso adalah 6,0
· &nbrp;
Tetraborate
elektrolit L iso adalah 7.6
Langkah-langkahnya
adalah
a.
kami
menemukan nilai T dari obat.
b.
kami
dalam multiplythe kuantitas obat dengan nilai E nya. Kami mendapatkan berat (x)
yang setara dengan natrium klorida terhadap tekanan osmotik.
c.
3.Karena,
untuk setiap 100 ml solusi, 0.9g natrium klorida diperlukan untuk isotonicity,
kita kurangi jumlah yang diperoleh pada langkah 2 (x) dari 0.9g; biarkan ini
menjadi y.
d.
Kami
menambahkan y NaCl, untuk setiap 100 ml larutan.
3. Metode White - Vincent:
3. Metode White - Vincent:
Dalam
metode ini kita menambahkan air yang cukup untuk obat tntuk membuat larutan
isotonik dan kemudian kita menambahkan larutan natrium klorida isotonik untuk
itu untuk membuka volume ke diperlukan tingkat.
Langkah-langkah
yang terlibat adalah
1.
Cari
berat yang ditentukan obat W (g), volume ditentukan V (v) dan natrium klorida
nilainya setara (E).
W. V = E
2.
Kalikan
berat W (g) dengan nilai setara natrium klorida (E).
W. E = X
Jadi X adalah berat natrium klorida
osmotik setara dengan W berat diberikan obat.
3. Volume (V) dari larutan isotonik
yang dapat disiapkan dari W (g) obat diperoleh dengan menyelesaikan persamaan
4. Jadi V adalah volume larutan yang
isotonik dengan darah. Larutkan Wg narkoba di Y ml air. Solusi ini isotonik. Sekarang,
pembuatan volume larutan ini diperlukan volume dengan larutan isotonik, seperti
solusi natrium klorida 0,9%.
4. Metode Sprowls :
Dalam
metode ini kita menggunakan nilai-nilai V yang didefinisikan dan dihitung untuk
banyak obat oleh Sprowls. Memperbaiki W sebagai 0.3g untuk obat banyak, dan mengetahui E mereka nilai-nilai yang dihitung nilai-nilai V untuk banyak obat.
banyak obat oleh Sprowls. Memperbaiki W sebagai 0.3g untuk obat banyak, dan mengetahui E mereka nilai-nilai yang dihitung nilai-nilai V untuk banyak obat.
Langkah-langkah:
1.
Menemukan nilai V dari meja. V adalah volume larutan yang isotonik dengan
darah untuk 0,3.
darah untuk 0,3.
2.
Dari jumlah obat yang diresepkan, menghitung volume. Misalkan, berat yang
ditentukan adalah X g. Untuk 0.3g,
volume air untuk isotonicity adalah v ml. Untuk XG, volume air?
3.
Sekarang larut XG di y ml air.
4.
Membuat sampai solusi ini dengan volume yang dibutuhkan dengan 0,9% natrium klorida larutan.
Contoh:
Natrium
klorida
1. Berapa banyak diperlukan untuk
membuat 100 ml larutan 1% dari apomorphine hydrochloride isotonik dengan serum
darah?
- Dari tabel, kita menemukan bahwa larutan 1% dari apomorphine hydrochloride menyebabkan titik beku penurunan 0,08oC.
1. Depresi di Point Pembekuan dibutuhkan
adalah 0,520. Depresi di Point Pembekuan tersedia 0,08. Depresi
lebih lanjut di Point Pembekuan dibutuhkan adalah 0,44. 0.58 Depresi C
di Point Pembekuan adalah disebabkan oleh larutan NaCl 1%. 0.44 oC
depresi di Point Pembekuan disebabkan oleh? Larutan NaCl?

Jadi
0,76 g dalam 100 ml NaCl akan memberikan penurun sebuah di Point Pembekuan 0,44.Jadi
untuk membuat obat yang dibutuhkan isotonik solusi, kami larut 1g hidroklorida
apomorphine dan 0,76 g natrium klorida dalam 100ml air.
Metode 2:
- Nilai T dari obat ini 0,14
- 1 x 0,14 = 0.14g
Ini
adalah jumlah setara natrium klorida untuk 1g hidroklorida apomorphine
- 0,9-0,14 = 0,76 g.
- Larutkan 1 gram hidroklorida apomorphine dan 0,76 g natrium klorida dalam 100ml air.
Metode 3:
- Berat obat = 1 gr
Volume larutan = 100 ml
Natrium Klorida Setara E = 0,14
- W x E = X
1 x 0,14 = 0,14
a.
V
= X x 111,1
= 0,14 x 111,1
= 15,55 ml
= 0,14 x 111,1
= 15,55 ml
- Larutkan 1 gram apomorphone hidroklorida dalam 15,5 ml air dan membuat solusi ini untuk 100ml dengan natrium klorida 0,9% solusi.
Metode 4:
- Nilai V dari apomorphine
hydrochloride adalah 4,7. Ini adalah volume air
diperlukan untuk 0.3g obat untuk isotonicity. - Y = V = 4,7 Xx/0.3 x1/0.3 = 15,66
- Larutkan 1 gram obat dalam 15,6 ml air dan membuat solusi untuk 100ml dengan larutan natrium klorida 0,9%.
DAFTAR PUSTAKA
Amidon, GL., Lennernas H, Shah VP, dan Crison JR. 1995. A Theoretical Basis For A Biopharmaceutic Drug
Classification: The Correlation Of In Vitro Drug Product Dissolution And In
Vivo Bioavailability. Pharm. Res.
12: 413-420, PMID 7617530.
Devane, J. 1998 . Oral
Drug Delivery Technology:
Addressing The Solubility/ Permeability Paradigm. Pharm`ceutical Technology. 11: 68-74.
Folkers, Gerd., Han van de Waterbeemd, Hans
Lennernäs, Per Artursson, Raimund Mannhold, dan Hugo Kubinyi. 2003 . Drug Bioavailability : Estimation of
Solubility, Permeability, Absorption and Bioavailability. Methods and Principles
in Medicinal Chemistry. Weinheim: Wiley-VCH,
ISBN 3-527-30438-X .
Lipinski,
Christopher A., Franco Lombardo, Beryl W. Dominy, dan Paul J. Feeney. 2001. Experimental And Computational Approaches To
Estimate Solubility And Permeability In Drug Discovery And Development Settings.
Advanced Drug Delivery Reviews. 46: 3–26.
Löbenberg,
Raimar., dan Gordon L. Amidon. 2000. Modern
Bioavailability, Bioequivalence And Biopharmaceutics Classifcation System. New Scientific
Approaches To International Regulatory Standards. European Journal of
Pharmaceutics and Biopharmaceutics. 50 : 3-12.